临床试验立项流程分为五个环节:
1. 项目承接意向沟通;
2. 注册账号,机构审核,资料上传浙江省医学研究伦理审查在线系统;
3. 机构形式审查,回复审查意见;
4. 复审,发放审查意见函
操作流程:
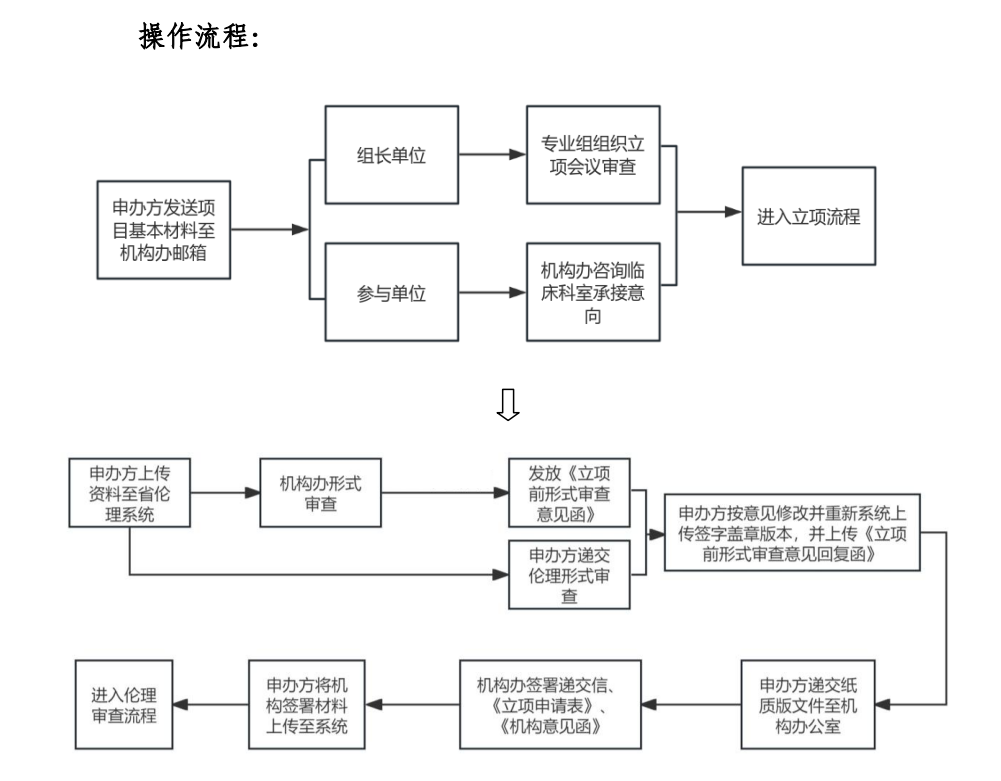
1. 项目承接意向沟通:
发送项目基本资料(方案摘要、组长单位、意向PI等)至机构邮箱hzqylcsyjg@126.com或电话咨询0571-85125997;获得同意承接后,进入立项流程。
2. CRA注册浙江省医学研究伦理审查在线系统(http://www.msttp.com:8586/#/login),立项资料上传,清单详见附件1.4和附件1.6。
注:
1)立项阶段可接受伦理前置。
2)立项阶段可接受暂无组长单位伦理批件,需提供暂无组长单位批件说明,并在伦理上会前补充递交至临床试验机构办公室。
3)立项形式审查阶段可接受未签字盖章版本资料。
4)药物临床试验项目需上传:附件1.3药物临床试验申请表、附件1.4药物临床试验试验前机构审查申请文件清单;医疗器械临床试验项目需上传:附件1.5医疗器械临床实验申请表、附件1.6医疗器械临床试验递交资料目录。
5)上传的研究方案、研究者手册、药物手册、知情同意书、日志卡、量表等文件需有版本号版本日期。量表需要装订成册。
6)研究者简历、利益冲突声明等文件建议使用伦理模板。
3.机构形式审查,时限2个工作日(可无需纸质文件)。
注:
此阶段同步联系伦理形式审查,复审阶段应按机构和伦理意见同步修改,上传最终版文件。
4. 机构复审,时限2个工作日。
注:
1)此阶段需发送所有文件省伦理系统,文件均需要加盖申办方公章,如申办方对CRO委托书已加盖申办方红章,其余材料可以加盖CRO公章;需要PI签字文件需上传PI签字的扫描件。
2)需同步上传立项审查费用付款回执。
5.发放机构审查意见函
① 通过复审后,与机构秘书联系,递交蓝色文件盒装订的纸质版文件至1号楼615办公室;
② 机构办同步签署递交信,机构办主任签署《药物临床试验申请表》和《机构意见审查函》。
③ CRA将签署后的上述文件上传至浙江省医学研究伦理审查在线系统,立项流程结束,进入伦理审查流程。
注:
另递交一个蓝色文件盒至1号楼615办公室用于日常文件归档。立项文件夹和机构文件夹侧签详见附件1.7。
伦理提交材料时,需同步提交PI在医学研究登记备案信息系统https://www.medicalresearch.org.cn/login备案的截图。
附件1.1-机构立项审查收费标准通知-20250409.pdf
附件1.2-杭州市七GCP项目-电子专票开具信息表-模版.xlsx
附件1.3-药物临床试验申请表.docx
附件1.4-药物临床试验试验前机构审查申请文件清单.docx
附件1.5-医疗器械临床试验申请表.docx
附件1.6-医疗器械临床试验递交资料目录.docx
附件1.7-侧签格式.docx