7.质控流程
点击量: 1537 日期: 2025-05-14
一、制定质控计划表
项目组根据一级质控的执行时点(见一级质控部分)制定质控计划表(药物见附件7.1,医疗器械见附件7.2),并保存于研究者文件夹。
二、启动质控
启动会召开后,首例入组前,CRA联系机构办公室进行启动质控。
三、一级质控
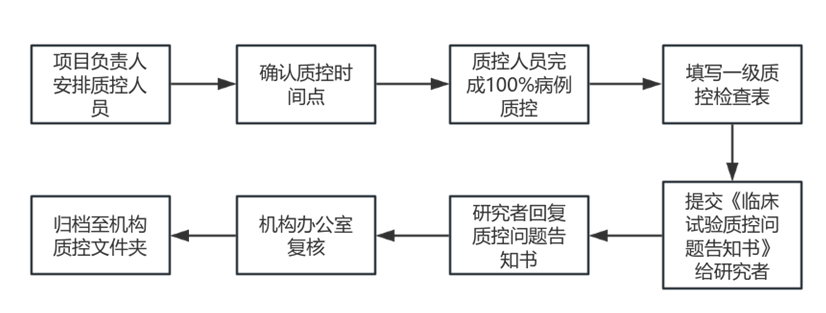
1. “一级质控”由该项目负责人(或与机构办公室主任协商)安排质控员组织完成。质控人员可为项目组成员。
2. 一级质控的执行时点:
(1)研究持续时间≤14 个月的试验至少安排 3 次一级质控,分别在以下时间段进行:①第1例受试者出组时;②已随机40%的受试者;③入组结束 。
(2)14 个月<研究持续时间≤28 个月的试验至少安排 4次一级质控,分别在以下时间段进行:①第1例受试者出组时;②已随机 30%的受试者;②已随机 60%的受试者;④入组结束。
(3)研究持续时间>28 个月的试验至少安排 5 次一级质控,分别在以下时间段进行:①第1例受试者出组时;②已随机 25%的受试者;③已随机 50%的受试者;④已随机 75%的受试者;⑤入组结束。
3. 一级质控病例数:在一级质控中,原则上 100%病例都应得到核查。
4. 质控员填写一级质控检查表(药品见附件7.3,医疗器械见附件7.4),并完成质控反馈并向主要研究负责人和机构质控组报告。质控检查表由档案管理员负责存放于该项目的“质量控制档案”中。 质控员发送《临床试验质控问题告知书》(附件7.5)。
5. 研究人员应定期完成整改。主要研究者督促落实整改质控所发现的问题。研究者在接到质控报告后回复《临床试验质控问题告知书》。递交机构办复核后,由档案管理员负责存放于该项目的“质量控制档案”中。
三、二级质控
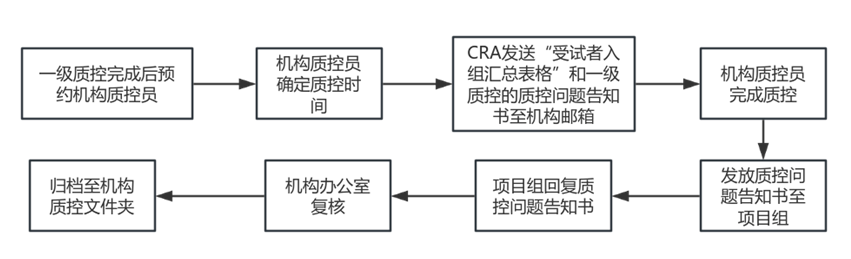
1. “二级质控”由机构办公室质控员完成;
2. 质控时间节点同一级质控;
3. 项目组完成一级质控后,CRA整理“受试者入组汇总表格”(附件7.6)和《临床试验质控问题告知书》发送至机构邮箱hzqylcsyjg@126.com。
4. 机构办公室安排好质控时间后通知CRA/CRC,进行二级质控。
5. 质控完成后,机构办公室发送“临床试验质控问题告知书”至项目组。项目组需在质控后2周内回复!
注: 锁库结题前要联系机构办公室进行结题质控!
项目组根据一级质控的执行时点(见一级质控部分)制定质控计划表(药物见附件7.1,医疗器械见附件7.2),并保存于研究者文件夹。
二、启动质控
启动会召开后,首例入组前,CRA联系机构办公室进行启动质控。
三、一级质控

1. “一级质控”由该项目负责人(或与机构办公室主任协商)安排质控员组织完成。质控人员可为项目组成员。
2. 一级质控的执行时点:
(1)研究持续时间≤14 个月的试验至少安排 3 次一级质控,分别在以下时间段进行:①第1例受试者出组时;②已随机40%的受试者;③入组结束 。
(2)14 个月<研究持续时间≤28 个月的试验至少安排 4次一级质控,分别在以下时间段进行:①第1例受试者出组时;②已随机 30%的受试者;②已随机 60%的受试者;④入组结束。
(3)研究持续时间>28 个月的试验至少安排 5 次一级质控,分别在以下时间段进行:①第1例受试者出组时;②已随机 25%的受试者;③已随机 50%的受试者;④已随机 75%的受试者;⑤入组结束。
3. 一级质控病例数:在一级质控中,原则上 100%病例都应得到核查。
4. 质控员填写一级质控检查表(药品见附件7.3,医疗器械见附件7.4),并完成质控反馈并向主要研究负责人和机构质控组报告。质控检查表由档案管理员负责存放于该项目的“质量控制档案”中。 质控员发送《临床试验质控问题告知书》(附件7.5)。
5. 研究人员应定期完成整改。主要研究者督促落实整改质控所发现的问题。研究者在接到质控报告后回复《临床试验质控问题告知书》。递交机构办复核后,由档案管理员负责存放于该项目的“质量控制档案”中。
三、二级质控

1. “二级质控”由机构办公室质控员完成;
2. 质控时间节点同一级质控;
3. 项目组完成一级质控后,CRA整理“受试者入组汇总表格”(附件7.6)和《临床试验质控问题告知书》发送至机构邮箱hzqylcsyjg@126.com。
4. 机构办公室安排好质控时间后通知CRA/CRC,进行二级质控。
5. 质控完成后,机构办公室发送“临床试验质控问题告知书”至项目组。项目组需在质控后2周内回复!
注: 锁库结题前要联系机构办公室进行结题质控!
上一篇:
1.临床试验立项流程
下一篇:
8.结题流程
